 |
|
01/03/1997 La
Recherche
DENIS
DUBOULE est professeur au département de zoologie et de
biologie animale de la faculté des sciences de Genève
duboule@sc2a.unige.ch
PAOLO SORDINO, assistant
dans le même département, est maintenant chercheur au King's
College à Londres.

 Le poisson-
zèbre et le coelacanthe. Le poisson-
zèbre et le coelacanthe.
 Figure
1. Figure
1.
 Figure
2. Figure
2.
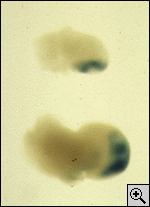 Figure 4. Figure 4.
*Les
nageoires de la plupart des poissons modernes, comme celles
des poissons ancestraux, possèdent des RAYONS OSSEUX , fines structures allongées qui
servent de charpente à leur partie distale et souple.
*Véritable fossile vivant, le COELACANTHE , poisson à nageoires lobées et
charnues, a été découvert pour la première fois en 1938 dans
l'océan Indien.
*LES POISSONS DE LA
FAMILLE DES PANDERICHTHYIDAE sont considérés
aujourd'hui comme les plus proches parents des premiers
tétrapodes.
*La couche ECTODERMIQUE
est située à l'extérieur du bourgeon. Elle provient d'un des
trois feuillets de cellules créés aux premiers stades du
développement embryonnaire : l'ectoderme.
*LA MÉTHODE D'HYBRIDATION IN SITU consiste à
visualiser au microscope les tissus, organes ou structures
après les avoir découpés en fines sections et mis en contact
avec des sondes radioactives capables de se fixer sur les
gènes à étudier.
*Les gènes associés aux complexes HoxA, HoxB, HoxC et HoxD sont appelés gènes
Hox. Ces gènes sont pléiotropes : ils contrôlent la formation
de différents systèmes et organes.
*L'HÉTÉROCHRONIE (du grec khronos
: le temps) correspond à une altération chronologique
dans l'apparition d'une fonction ou d'une structure d'un
organisme vivant par rapport à son ancêtre ou à l'espèce
voisine.

(1) R. Owen, On the
nature of limbs, Van der Hoorst J, 1849.
(2) C.
Gegenbaur, Jena Z Naturw, 7, 131, 1872.
(3) J.R
Hinchliffe et D.R. Johnson, The development of the
vertebrate limb, Clarendon Press, 1980.
(4) M.I.
Coates, Development, suppl., 169, 1994.
(5) N.
Shubin, « The evolution of paired fins and the origin of
tetrapod limbs. Phylogenetic and transformational approaches
». Evolutionary biology, M.K. Hecht, R.J. Macintyre,
M.T. Clegg (éds), Plenum Press, NY, 39, 1995.
(6) N.
Holmgren, Acta Zoologica, 114, 184 Stockholm, 1933.
(7) N.H. Shubin et P.A. Alberch, « A morphogenic approach
to the origin and basic organisation of the tetrapod limb »,
Evolutionary biology, M.K. Hecht, B. Wallace, G.I.
Prance (éds), Plenum Press, NY, 319, 1986
(8) J.R.
Hinchliffe, « Developmental approaches to the problem of
transformation of limb structure in evolution », in
Developmental patterning of the vertebrate limb, 313,
Plenum Press, 1991.
(9) W. McGinnis et al., Nature,
308, 428, 1984.
(10) M.P. Scott et A.J. Weiner, P
roc. Natl. A cad. Sci., 81, 4115, 1984.
(11) D.
Duboule et P. Dollé, EM BO J., 8, 1497, 1989.
(12)
D. Duboule, Science, 266, 575, 1994.
(13) P.
Sordino, F. Van der Hoeven et D. Duboule, Nature, 375,
678, 1995.
(14) F. Van der Hoeven, et al., «
Teleost HoxD and HoxA genes : comparison with tetrapods and
functional evolution of HoxD complex », Mech. Dev.,
54, 9, 1997.
La
Recherche a publié :
(I)Denis Duboule et
al. , « Les gènes du développement chez les mammifères »,
mars 1990.
(II)W. Gehring, « De la mouche à l'homme, un
même supergène pour l'oeil », octobre 1995.
| |
 |
|
|
> DOSSIER
>
EMBRYOLOGIE
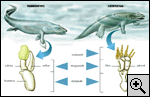
Chez les poissons, la machinerie
génétique a préféré la solution nageoire
L'origine des doigts
Les
doigts courts et larges des premiers tétrapodes auraient
d'abord servi de pagaies et non, comme nous pourrions le
croire, de pinces pour sortir de l'eau. Mais d'où viennent ces
doigts ? Ont-ils été créés à partir d'une structure ancestrale
? Comment sont-ils apparus ? La question longtemps débattue
semble enfin avoir une réponse. Il s'agit probablement d'une
bifurcation génétique tardive pendant le développement de la
nageoire.
L'histoire
évolutive de nos mains et de nos pieds commence il y a environ
380 millions d'années par une surprenante métamorphose : le
passage de la nageoire au membre, étape décisive dans
l'évolution des vertébrés. Tout aussi extraordinaire,
l'apparition des doigts est à l'origine d'un débat encore très
animé(1-5). Le récit de cette controverse scientifique débute
vers la fin du XIXe siècle avec les premières observations
paléontologiques des nageoires de poissons ancestraux. Les
grandes similitudes entre leurs rayons osseux*
et les doigts des tétrapodes primitifs conduisent un certain
nombre de paléontologues de cette époque à penser qu'il existe
une relation directe entre ces deux types de structures. Selon
eux, les doigts seraient le résultat d'une simple
transformation morphologique. Dans les années 1950-1960, un
paléontologue suédois, Erik Jarvik, va défendre un tout autre
point de vue. Inspiré des travaux de l'embryologiste Niels
Holmgren(6), Jarvik interprète les doigts comme des structures
néomorphes, nouvellement formées. Pour lui et quelques autres
paléontologues, les petits bouts d'os présents à l'extrémité
des nageoires des poissons ancestraux (tel le Coelacanthe*
ou les poissons de la famille des Panderichthyidae *)
ne peuvent être considérés comme les précurseurs des doigts
des premiers tétrapodes (voir l'article de J. Clack dans ce
numéro). Mais cette nouvelle interprétation de l'origine des
doigts est loin de faire l'unanimité et les deux écoles vont
s'affronter trente années durant. La thèse suédoise soulève en
effet une question supplémentaire : comment expliquer, dans
ces conditions, la ressemblance parfaite entre les autres
éléments osseux de la nageoire (humérus, radius et cubitus) et
les trois os principaux du membre postérieur des premiers
tétrapodes (fémur, tibia et péroné) (fig.
1) ?
L'enquête scientifique va prendre un tournant décisif à
la fin des années 1980 grâce à la rencontre de l'embryologie
classique et moléculaire. Les nouvelles observations de
l'embryologie classique vont nous apprendre beaucoup sur le
développement des membres(7,8) et des nageoires. Résumons
brièvement ces différents résultats expérimentaux.
Chez les tétrapodes, tout commence par un
bourgeonnement et par la différenciation d'une couche de
cellules à la périphérie de ce bourgeon (fig.
2a). Cette couche dite ectodermique*
agit comme un bouclier : sous elle, les cellules proli-fèrent
et construisent la partie osseuse du squelette appelé
l'endosquelette. Puis, pour des raisons encore mal comprises,
des cellules de la partie basse du bourgeon vont commencer à
proliférer plus rapidement et à envahir petit à petit la
partie avant du bourgeon : c'est dans cette zone avant que les
doigts vont finalement se former.
Ces observations ont apporté la preuve que le membre
des tétrapodes se fabri- que bien progressivement, de
l'arrière vers l'avant. Ainsi, chez l'homme, cette
construction commence par la production du bras (le
stylopode), suivie par l'avant-bras (le zeugopode) puis par le
poignet et la main (l'autopode). Morphogénétiquement parlant,
nos mains sont donc plus jeunes que nos bras.
Chez les poissons, tant cartilagineux (requin, raie,
etc.) qu'osseux (truite, carpe, etc.), le développement des
nageoires semble être contrôlé au tout début par des
mécanismes très voisins de ceux des membres des tétrapodes
(fig. 3 a) : on assiste d'abord à la naissance du bourgeon,
puis à l'émergence de la couche ectodermique. Mais à ce stade,
un phénomène nouveau se produit. En quelques heures la
multiplication des cellules est telle que la couche se
recourbe en formant un pli allongé. L'espace vide situé à
l'intérieur du pli va petit à petit se trouver colonisé par un
type très particulier de cellules, dont l'origine reste assez
mystérieuse. Quelques heures plus tard, celles-ci formeront ce
que les spécialistes appellent « le squelette dermique »,
c'est-à-dire les rayons flexibles de la nageoire. Dans la
partie arrière du bourgeon, l'endosquelette possède Ñ selon le
type de poisson Ñ un nombre variable d'éléments : il est en
général considérablement réduit chez les poissons « modernes
», comme la truite ou la dorade, au bénéfice du squelette
dermique au contraire très bien développé.
D'un point de vue embryologique, le développement de la
nageoire est donc marqué par le repliement de la couche
ectodermique. On suppose aujourd'hui que ce repli empêche la
transmission de l'information de croissance au reste du
bourgeon. L'endosquelette s'arrête de croître. Chez les
tétrapodes, il n'y a pas de repli : la couche ectodermique
peut continuer à fournir l'information de croissance aux
autres cellules du bourgeon. Sous ces conditions, les doigts
naissent d'une surprolifération cellulaire dans la partie
basse du bourgeon.
Ces résultats expérimentaux mettaient en évidence des
différences fondamentales entre les modes de développement des
nageoires et des membres. Mais plusieurs questions restaient
sans réponse : comment de telles différences avaient pu
générer des éléments structuraux si semblables entre la
nageoire et le membre (les éléments osseux de la nageoire et
ceux du membre antérieur) et quels étaient les processus
génétiques responsables de ces comportements cellulaires ?
Retour quelques années en arrière, début 1980, avec le
démarrage de l'embryologie moléculaire des vertébrés(9-11) :
les nouvelles techniques de génie génétique allaient nous
faire découvrir des gènes très particuliers, appelés gènes
homéotiques, qui commandent et contrôlent Ñ entre autre Ñ le
développement des membres des tétrapodes. Grâce à ces
techniques tout un champ d'expériences s'ouvrait à nous.
Par la méthode d'hybridation in situ *, nous
pouvions enfin localiser précisément les domaines d'expression
de chacun de ces gènes. Autrement dit, prévoir où et quand ces
gènes interviennent dans le développement des différents
organes. Les doigts s'étaient-ils développés à partir d'un
élément présent sur la nageoire ou bien s'agissait-il d'une
véritable innovation morphologique ? La génétique et
l'embryologie allaient peut-être nous permettre de tester les
hypothèses des uns et des autres. En quelques années cette
technique s'est effectivement montrée très performante et nous
a permis de décrypter la fonction et l'action de plusieurs
dizaines de gènes homéotiques au cours des principales étapes
de la morphogenèse des membres et des nageoires. Ces nouvelles
expériences permirent d'étayer une idée déjà supportée par les
études comparatives des bourgeons de nageoire et de membre, à
savoir l'existence d'une sorte de bifurcation dans les phases
tardives de leur développement.
Chez les mammifères, les homéogènes sont regroupés en
quatre complexes HoxA , HoxB , HoxC et
HoxD * ( Hox est une abréviation pour H
oméob ox) localisés sur des chromosomes
différents(I,II). Très récemment, dans une étude portant sur
la souris, nous avons constaté que les gènes HoxD
s'exprimaient dans des régions différentes du membre
pendant son développement (fig. 2b et 4). Dans une première
phase (correspondant au début du bourgeonnement), ces gènes
s'expriment suivant une stratégie de poupées russes centrée
sur la partie basse du bourgeon. Dans une seconde phase, lors
de la formation des doigts, leur domaine d'expression s'étend
vers l'extrémité avant et les bords supérieur et inférieur du
bourgeon(12).
Ce mécanisme est-il observé chez les poissons ? Pour
répondre à cette question, il nous faut d'abord caractériser
leur bagage génétique c'est-à-dire identifier les complexes
Hox responsables de leur développement. Par clonage des
gènes Hox d'un petit poisson du Gange, le poisson-zèbre
(le Danio rerio ), nous avons retrouvé les quatre mêmes
complexes A, B, C, D, qui caractérisent donc tous les
vertébrés(13,14). Premier élément important : le passage des
poissons aux tétrapodes n'a donc pas été accompagné d'une
augmentation du nombre de gènes Hox. Sur la base de
cette découverte, nous avons suivi, dans un deuxième temps,
l'activation des gènes au cours du développement de la
nageoire pectorale (celle située à l'avant, homologue à nos
bras) du poisson-zèbre(12).
Cette étude a permis de montrer qu'il existait au stade
précoce du développement une grande similitude entre ce petit
poisson et la souris, les gènes HoxD s'exprimant
essentiellement dans la partie basse de la future nageoire
(fig. 3b). En revanche, dans le stade morphogénétique plus
avancé, aucune activation de ces gènes n'est détectée dans la
partie avant et sur les bords inférieur et supérieur du
bourgeon comme c'est le cas chez la souris. Seule donc la
phase précoce d'expression des gènes HoxD est
observée chez les poissons. Il en est de même des gènes du
complexe HoxA qui, au stade avancé du développement, ne sont
pas activés de la même façon chez les poissons et les
tétrapodes.
Une différence fondamentale dans la phase terminale de
la morphogenèse suggère que les doigts sont bien des
structures nouvellement formées
D'un point de vue strictement moléculaire, la phase I
du développement fait donc intervenir les mêmes gènes aux
mêmes endroits chez le poisson et la souris, ce qui, à notre
avis, explique les similitudes morphologiques (homologie)
entre certains éléments osseux de la nageoire et les trois os
principaux du membre. En revanche, la nageoire semble être
dépourvue de la phase terminale présente dans la morphogenèse
des membres. Cette différence fondamentale suggère que les
doigts sont bien des structures nouvellement formées.
Les poissons pourraient-ils fabriquer des doigts ? Il
est probable qu'ils en ont bel et bien le potentiel génétique
mais qu'ils en sont empêchés au stade avancé du développement.
Seule responsable de leur évolution morphologique, la
machinerie génétique a choisi pour eux la solution «
nageoire ». Peut-on pour autant en conclure que ces choix
génétiques sont les véritables initiateurs du passage de la
nageoire au membre il y a environ 380 millions d'années ? Posé
de cette façon, le problème reste entier. Les mécanismes
moléculaires que nous avons décrits constituent une solution
possible. Mais si cette solution est bien la bonne, quel
scénario évolutif pouvons-nous proposer ? Il semble que le
facteur déterminant du choix entre les rayons flexibles et les
doigts soit le moment précis auquel la croissance du bourgeon
diminue, suite au repli de la couche ectodermique. Il
s'agirait donc d'une illustration très réussie d'un mécanisme
d'hétérochronie* par lequel un temps Ñ celui du repli Ñ
détermine la structure finalement produite : le repli est
précoce et les rayons apparaissent, le repli est tardif (ou
inexistant) et les doigts apparaissent. Une innovation
morphologique qui aurait précédé de plusieurs millions
d'années la colonisation de la terre ferme.
Denis Duboule
et Paolo Sordino 
J.R. Hinchliffe et D.R. Johnson, The development of
the vertebrate limb, Oxford science publications,
Clarendon Press, 1980.
J.R. Hinchliffe, J. Huerle et D. Summerbell, «
Developmental patterning of the vertebrate limb », N ATO
ASI series, 205, Plenum Press, New York and London, 1991.
D. Duboule, Guidebook to the Homeobox Genes,
Oxford University Press, 1994. SPECIAL : L'HISTOIRE DE LA VIE
EMBRYOLOGIE
|
|
 |

